| 研究課題 C01-4 | 超高分解能/多核種同時測定インビボイメージングを可能にする分子プローブの開発 |
|---|---|
| 研究代表者 | 梅田 泉 (東京大学) |
核医学は放射線医学の一領域で, 放射性同位元素(RI)を含む医薬品を患者に投与し, 画像診断や治療を行います。医療画像診断のうち, X 線や超音波, MRI 検査は主に人体の解剖学的情報や病変の形態に関する情報を与えます。これに対して, 核医学画像診断 (イメージング) は, 放射性核種(RI)で標識した化合物や高分子をプローブとして(= 放射性医薬品), これを生体に投与し、それぞれのプローブの性質に応じた体内動態や病巣集積などを放出される放射線(γ 線)を体外から追跡することで, 血流や代謝, 受容体分布などの生理機能の情報を与えることが出来ます。また核医学イメージングは, 生理現象の研究にも重要です。これまで生理現象の研究には, 細胞や組織をすりつぶして解析する生化学や分子生物学的手法や, 組織を摘出, 固定し, 切片にして解析する組織・病理学的手法などが用いられてきました。これに対して核医学イメージングは, 生きたまま, 侵襲を与えることなく, 生理現象を画像としてとらえ, 複雑かつダイナミックな生理現象を一個体で経時的に観察することができます。小動物を用いた in vivo イメージングは重要な研究手段となっています。さらに近年では, α 線や β 線の殺細胞作用を利用した核医学治療薬の開発も進んでおり, 同時に γ 線を放出する核種などを用いて画像診断と治療を同時に行う radio-theranostics という分野にも大きな注目が集まっています。通常の薬剤は投与後に標的病巣に届いているのかどうか知ることはできませんが, radio-theranostics 製剤はそれが可能であり, 治療効果や副作用の予測, 早期の効果判定などが期待されています。
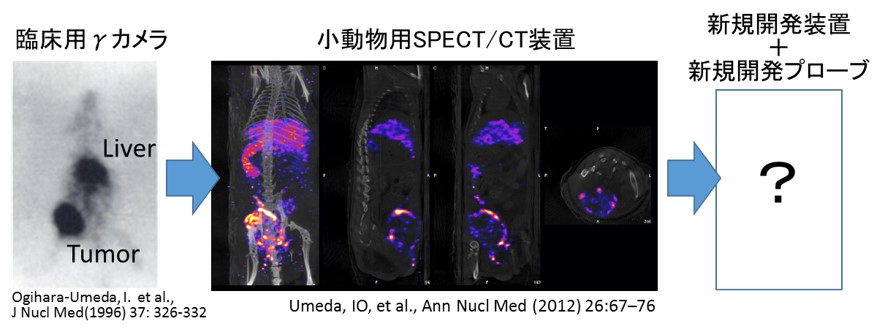
 しかし一方で, 現状の核医学イメージングは他の画像診断に比して空間分解能が不良であり, 現時点では臨床機で 3–5 mm, 小動物専用装置でも 1–2 mm 程度に留まっています。例えば腫瘍病巣では不均一な細胞分布, 微小環境が知られていますが, 現時点では, これらを明瞭に描画することは困難で, 治療効果予測も不十分と考えられます。これは主に放射線検出装置の性能に依存します。計画研究 C01 班で開発が進められている, 宇宙観測研究から生まれた新しいイメージング装置は超高空間分解能(<100 µm)をもち, かつエネルギー分解能も極めて高く, 核医学イメージングにとって極めて魅力的です。ただ, 単に装置性能を向上させただけでは, 優れた画像を得ることはできません。高空間分解能画像を可能にする十分量の放射活性と高い signal/noise (S/N) 比が必要です。核医学イメージングにとって, 検出装置とプローブは車の両輪であり, 装置の性能を最大限に活かすためには, その装置に適したプローブを開発することが必要です。
しかし一方で, 現状の核医学イメージングは他の画像診断に比して空間分解能が不良であり, 現時点では臨床機で 3–5 mm, 小動物専用装置でも 1–2 mm 程度に留まっています。例えば腫瘍病巣では不均一な細胞分布, 微小環境が知られていますが, 現時点では, これらを明瞭に描画することは困難で, 治療効果予測も不十分と考えられます。これは主に放射線検出装置の性能に依存します。計画研究 C01 班で開発が進められている, 宇宙観測研究から生まれた新しいイメージング装置は超高空間分解能(<100 µm)をもち, かつエネルギー分解能も極めて高く, 核医学イメージングにとって極めて魅力的です。ただ, 単に装置性能を向上させただけでは, 優れた画像を得ることはできません。高空間分解能画像を可能にする十分量の放射活性と高い signal/noise (S/N) 比が必要です。核医学イメージングにとって, 検出装置とプローブは車の両輪であり, 装置の性能を最大限に活かすためには, その装置に適したプローブを開発することが必要です。
私共は放射性医薬品化学を専門とし, これまでに化合物の分子設計や, 薬物送達システム(DDS)の応用などにより, プローブの体内動態を巧みに制御し, 標的集積性や S/N 比を劇的に向上させる手法を開発してきました。本研究ではこれらの知見を元に, 装置開発チームと協力して当該装置の特性を踏まえた最適なプローブを開発することにより, 従来にない, 超精密空間分解能, 多核種同時測定が可能な in vivo 核医学イメージング手法の確立を目指します。目的の達成は, 腫瘍内微小環境の変化, 脳内の微小な変性タンパク質沈着の経緯, 再生医療における幹細胞動態等々を in vivo で観察する手法の開発等に繋がると期待されます。
メンバー
- 研究代表者
- 梅田 泉
(東京大学 国際高等研究所 カブリ数物宇宙研究機構 (Kavli IPMU) )
- 研究協力者
-
柳下 淳 (東京大学 国際高等研究所カブリ数物連携宇宙研究機構)
武田 伸一郎 (東京大学 国際高等研究所カブリ数物連携宇宙研究機構)
高橋忠幸 (東京大学 国際高等研究所カブリ数物連携宇宙研究機構)
藤井博史 (国立がん研究センター先端医療開発センター)
関連資料
- S. Kimura, I. O. Umeda, N. Moriyama, H. Fujii, “Synthesis and evaluation of a novel (99m)Tc-labeled bioreductive probe for tumor hypoxia imaging,” Bioorg. Med. Chem. Lett. 24, 7359–7362 (2011).
- I. O. Umeda, H. Fujii et al., “High resolution SPECT imaging for visualization of intratumoral heterogeneity using a SPECT/CT scanner dedicated for small animal imaging,” Ann. Nucl. Med. 26, 67–76 (2012).
- M. Ogawa, I. O. Umeda et al., “Development of 111In-labeled liposomes for vulnerable atherosclerotic plaque imaging,” J. Nucl. Med. 55, 115–120 (2014).
- K. Ito, I. O. Umeda, H. Fujii et al., “Radiolabeled liposome imaging determines an indication for liposomal anticancer agent in ovarian cancer mouse xenograft models,” Cancer. Sci. 107, 60–67. (2016).
- Y. Hori, I. O. Umeda, H. Fujii et al., “Functional characterization of VEGF- and FGF-induced tumor blood vessel models in human cancer xenografts,” Anticancer Res. 37, 6629–6638 (2017).
- 梅田泉, 藤井博史, 「臨床応用を目指した分子イメージング研究の現状と今後の展望」, 日本耳鼻咽喉科学会会報 116, 933–940 (2013).
