| 研究課題 C01-10 | 脳病態時における中枢神経系リンパ管の免疫細胞応答イメージング |
|---|---|
| 研究代表者 | 水間 広 (理化学研究所) |
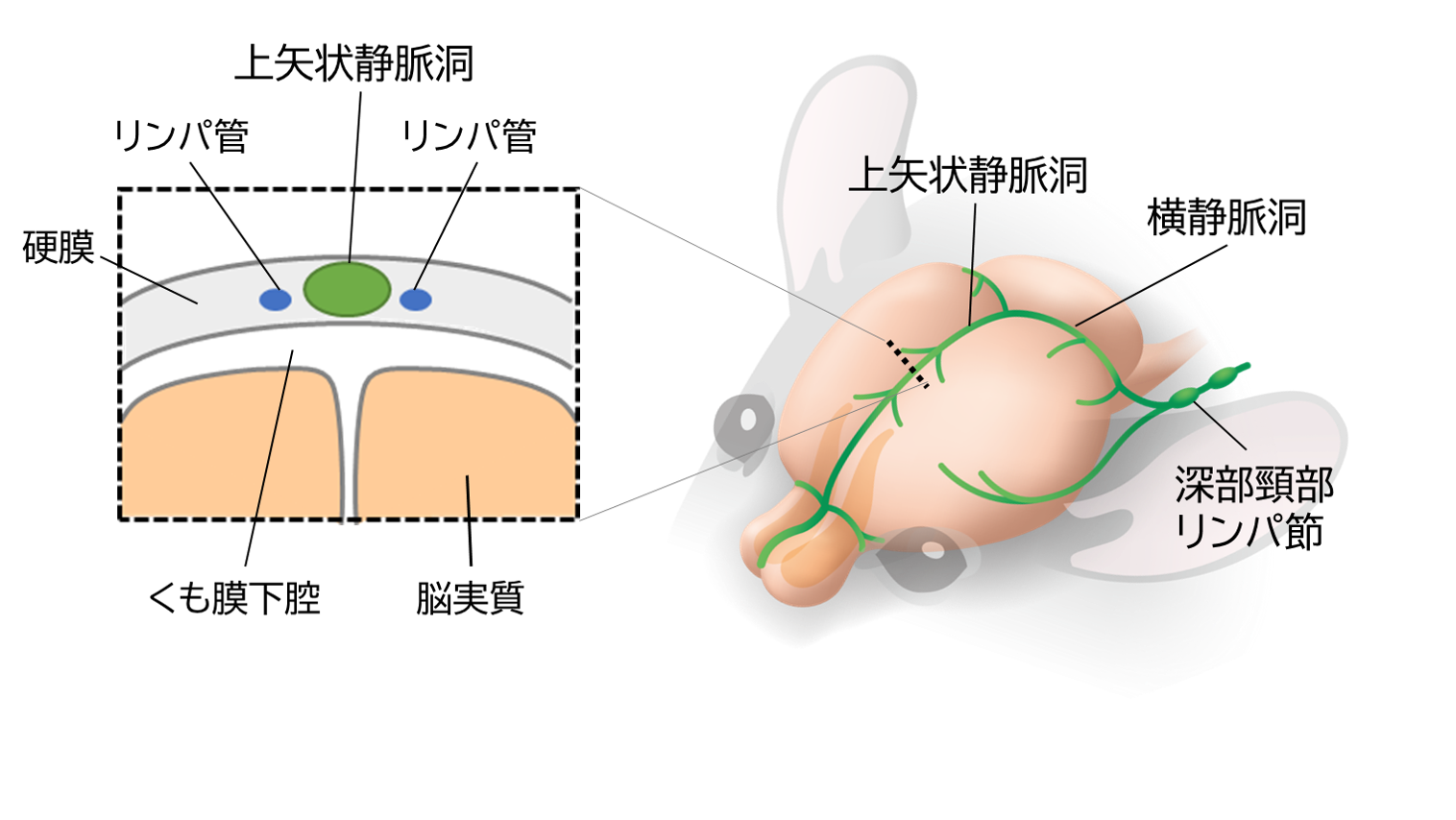
中枢神経組織である脳・脊髄には「免疫特権」と呼ばれる末梢組織から独立した免疫体系を持つことが知られています。中枢神経系ではグリア細胞が免疫機能の役割を持つが, グリア細胞のみでは中枢神経系における全てのリンパ系機能を果たすことは不十分であると考えられていました。また, リンパ管のもう一つの重要な役割である老廃物の排泄においても中枢神経系では不明な点が多いことから, リンパ管の存在は予見されていました。中枢神経系リンパ管の存在は, 18 世紀末, イタリア人医師である Mascagni は自らの緻密な解剖所見から脳髄膜に存在することを主張しましたが, 当時の医学的技術では証明するまでには至りませんでした。遅れて 1953 年に Lecco はヒトの脳硬膜の検体からリンパ管を採取したことを報告しましたが, 決定的な証拠を見出すことが出来ませんでした。2015 年, 最先端の蛍光顕微鏡および遺伝子改変技術を用いた研究が, 2 つの異なる研究グループ(Aspelund らと Louveau ら)から相次いで報告がなされ, マウス脳脊髄膜に末梢組織と同じような構造と機能を持つリンパ管が分布している事を発見しました。この発見以降, リンパ管はマウス以外にヒトを含む多くの動物種で保存されている器官であることも明らかとなり, 正常機能のみならず認知症や脳腫瘍などの病態との関連性も報告され, 重要な役割を持つことが示唆されました。
私たちは第 1 回公募研究にて採択された「高性能 SPECT を用いた中枢リンパ系ドレナージの循環動態イメージング法の開発」において, この中枢神経系リンパ管の循環動態を可視化することを目的に, 宇宙観測技術をベースに開発された高性能 SPECT 装置を利用した研究に着手しました。その結果, マウス髄腔内への放射性核種標識プローブの投与法および撮影法を確立し, 世界で初めてマウスの高精細な画像を取得することに成功しました。本研究課題では開発された髄膜リンパ管イメージング手法を用いて, より医学研究へと応用展開するため, 認知症および脳腫瘍の疾患をターゲットとし, 病態の進行に伴い変化する免疫系細胞の動態を SPECT イメージングにより可視化することを目的とします。本研究により, 認知症や脳腫瘍における中枢神経リンパ系の機能的役割を明らかにし, 新たな診断技術の創出および治療戦略モデルの構築を目指します。
メンバー
- 研究代表者
-
水間 広

(理化学研究所 生命機能科学研究センター (BDR))
- 研究協力者
-
金山 洋介 (理化学研究所 生命機能科学研究センター (BDR))
武田 伸一郎 (東京大学 国際高等研究所 カブリ数物宇宙研究機構 (Kavli IPMU) )
高橋 忠幸 (東京大学 国際高等研究所 カブリ数物宇宙研究機構 (Kavli IPMU) )
藤井 博史(国立がん研究センター 先端医療開発センター)
OLTEA, Sampetrean (慶應義塾大学 医学部先端医科学研究所)
関連資料
- H. Mizuma et al., “Establishment of in vivo brain imaging method in mice under conscious condition,” J. Nucl. Med. 51, 1068–1075 (2010).
- Y. Hara et al., “Involvement of the septo-hippocampal cholinergic pathway in association with septal acetylcholinesterase upregulation in a mouse model of tauopathy,” Curr. Alzheimer. Res. 14, 94–103 (2017).
- N. Nakai et al., “Serotonin rebalances cortical tuning and behavior linked to autism symptoms in 15q11-13 CNV mice,” Sci. Adv. 3, e1603001 (2017).
- T. Furuse et al., “A new mouse model of GLUT1-deficiency syndrome exhibits abnormal sleep-wake patterns and alterations of glucose kinetics in the brain,” Dis. Model. Mech. 12, dmm038828 (2019).
- K. Zhang et al., “PET imaging of neural activity, β-amyloid, and tau in normal brain aging,” Eur. J. Nucl. Med. Mol. Imaging, in press (2021).