| 研究課題 C01-8 | 微小胃がん腹膜播種の検出を可能とする放射線イメージング技術の開発 |
|---|---|
| 研究代表者 | 熊倉 嘉貴 (埼玉医科大学) |
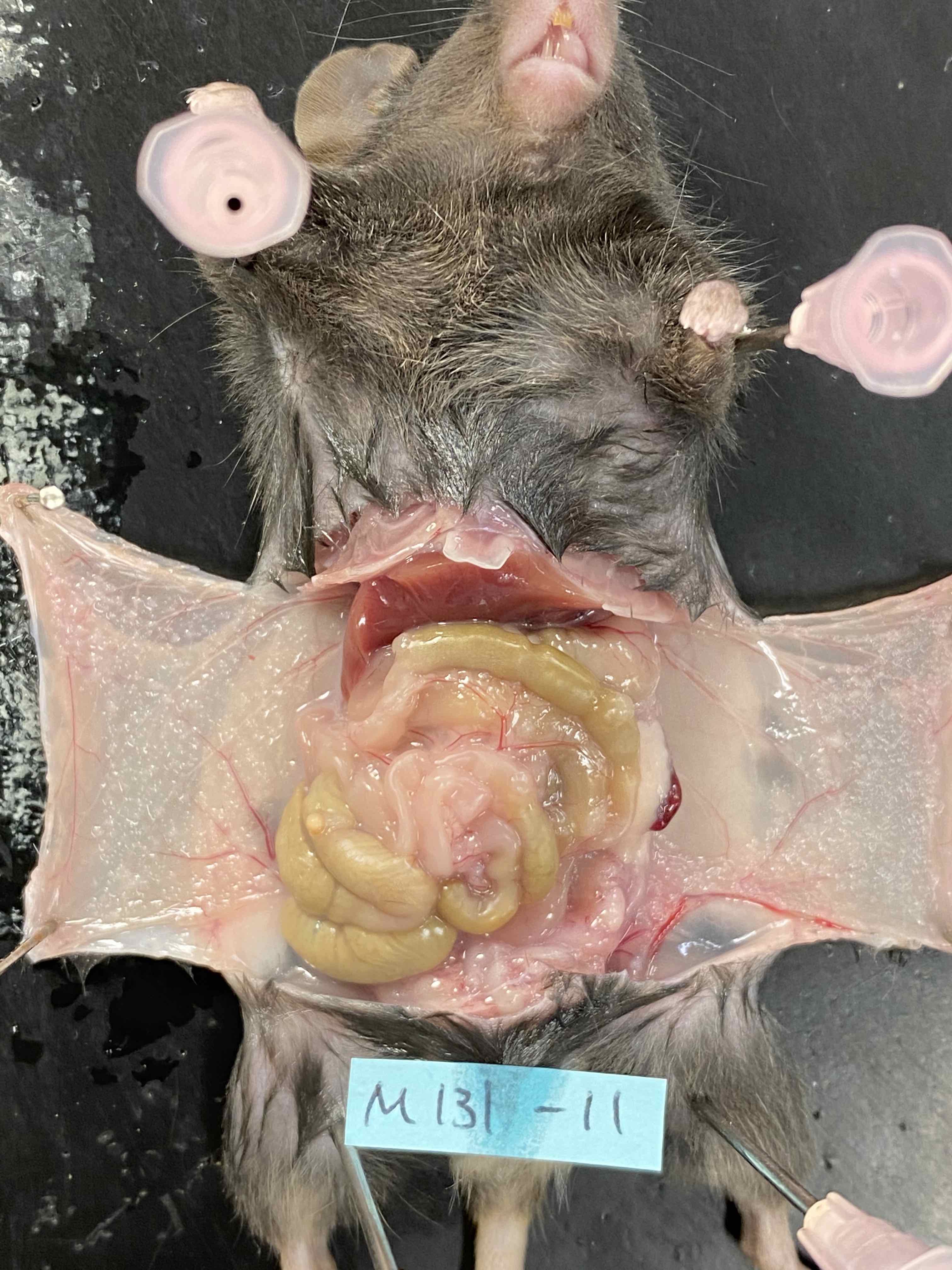
元来, 核医学はブドウ糖やアミノ酸のような小分子を用いて, 人体臓器の生理的, および生化学的な異常を可視化するための非侵襲的定量イメージング技術です。この臨床技術は, 特定の人体臓器に集積するように設計された放射性標識医薬品を使用します。放射能の分布は, 陽電子放射断層撮影法 (PET) の断層画像として得ることができます。近年の空間分解能の向上のおかげで, 小動物を用いた前臨床 PET イメージングが, 新薬の候補物質開発のための強力なツールとなっています。こうした候補物質には, 腫瘍に特異的なモノクローナル抗体が含まれます。現在, 小動物 PET イメージングは, 免疫不全ヌードマウスに移植された腫瘍へのモノクローナル抗体結合を評価するために必要不可欠です。モノクローナル抗体に α 線(あるいは β 線)放出核種を組み込むことによって, 極めて腫瘍細胞に特異的な細胞障害を達成することができます。この際に, PET イメージングは改変モノクローナル抗体の生体内分布の最適化に有用です。この分子イメージング技術と一対となって新しく出現した治療技術(セラノスティックス)は, 癌患者の治療のために大きな注目を集めています。高い線エネルギー付与を有する α 線粒子の砲撃は, モノクローナル抗体によって腫瘍細胞の表面抗原に届けられます。この結果, DNA 二重らせんの切断を生じ, 最終的にアポトーシスや壊死を誘導します。我々は, 胃癌腹膜播種のための新しいセラノスティックス戦略の開発を目指します。治療用の α 線放出核種として, 211-アスタチン(211At, 半減期: 7.2 時間)は, 有望なハロゲン核種で, サイクロトロンでの生産が可能です。しかし, 現在の小動物イメージング技術は 211At が放出する低エネルギー X 線 (77–92 keV) や乏しい高エネルギー γ 線 (570 and 898 keV, <1%) の生体内分布を可視化するには適していません。すなわち, 211At によるセラノスティックスをワンストップ・ショップで実現するためには, 211At の高分解能イメージングが課題として残っています。我々は, 胃癌腹膜播種の小動物モデルを用いて, 211At 核医学治療の効果, および従来の小動物 PET 画像と比較検討しつつ, 新しい 211At イメージング技術が学際的な共同研究によって探索されることを希望しています。
メンバー
- 研究代表者
-
熊倉 嘉貴
(埼玉医科大学 医学部)
- 研究協力者
-
野村 幸世 (東京大学 大学院医学系研究科 消化器外科学)
和田 洋一郎 (東京大学 アイソトープ総合センター)
秋光 信佳 (東京大学 アイソトープ総合センター)
杉山 暁 (東京大学 アイソトープ総合センター)
羽場 宏光 (理化学研究所 仁科加速器科学研究センター)
関連資料
-
M. Yamamoto ,S. Nomura ,A. Hosoi , et al., “Established gastric cancer cell lines transplantable into C57BL/6 mice show fibroblast growth factor receptor 4 promotion of tumor growth,” Cancer Sci. 109(5), 1480–1492 (2018). -
D. Fujimori ,J. Kinoshita ,T. Yamaguchi , et al., “Established fibrous peritoneal metastasis in an immunocompetent mouse model similar to clinical immune microenvironment of gastric cancer,” BMC Cancer 20(1), 1014 (2020). -
K. Nagaoka ,M. Shirai ,K. Taniguchi , et al., “Deep immunophenotyping at the single-cell level identifies a combination of anti-IL-17 and checkpoint blockade as an effective treatment in a preclinical model of data-guided personalized immunotherapy,” J. Immunother. Cancer 8(2), e001358 (2020). -
T. Kawato ,E. Mizohata ,Y. Shimizu , et al., “Structure-based design of a streptavidin mutant specific for an artificial biotin analogue,” J. Biochem. 157(6), 467–475 (2015). - 羽場宏光, 「理研における核医学治療用ラジオアイソトープの製造」, Drug Deliv. Syst. 35(2), 114–120 (2020). DOI: 10.2745/dds.35.114 .